Para probar el argumento de Jan, hice un análisis NBO de su estructura (optimizado en PBE-D3 / def2-SVP con NWChem 6.6 usando una búsqueda conformacional con MMFF94s y Avogadro como punto de partida; el cálculo de frecuencia determinó que era un mínimo real). Usé la versión 5.9 de NBO.
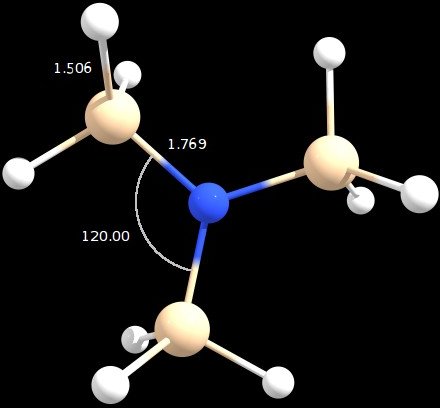
Figura 1 : geometría optimizada (ángulos en grados y distancias en angstrom )
La geometría obtenida está en perfecto acuerdo con la respuesta de Jan, mostrando un ángulo $ \ ce {Si-N-Si} $ de 120 ° .
Las cinco energías de estabilización de segundo orden NBO más significativas son:
| | E (2) | E (j) -E (i) | F (i, j) Donante NBO (i) | Aceptador NBO (j) | kcal / mol | a.u. | au ============== | ================== | ========== | ==== ======= | ======== LP (1) N 1 | BD * (1) Si 2- H 6 | 5,08 | 0,43 | 0,043 LP (1) N 1 | BD * (1) Si 2- H 7 | 5,08 | 0,43 | 0,043 LP (1) N 1 | BD * (1) Si 3 - H 8 | 5,08 | 0,43 | 0,043 LP (1) N 1 | BD * (1) Si 3 - H 9 | 5,08 | 0,43 | 0,043 LP (1) N 1 | BD * (1) Si 4-H12 | 5,08 | 0,43 | 0,043 LP (1) N 1 | BD * (1) Si 4-H13 | 5,08 | 0,43 | 0.043
Es decir, un $ \ ce {n_ \ ce {N}} \ rightarrow \ sigma ^ * (\ ce { Si-H}) $ donación, por valor de 5,08 kcal / mol cada una, parece ser la deslocalización más significativa.
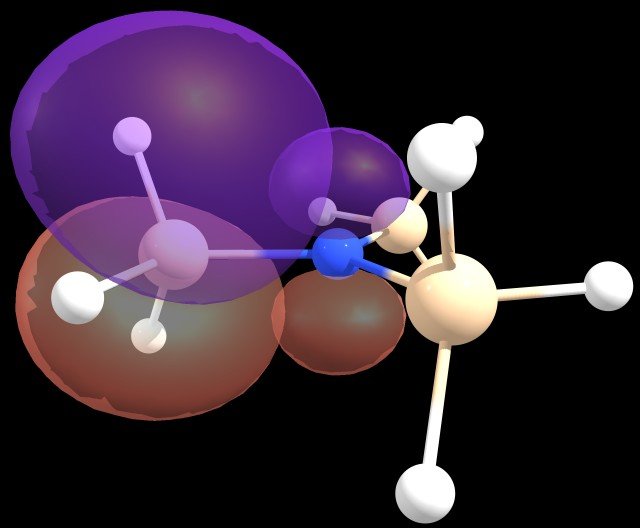
Figura 2 : $ \ ce {n_ \ ce {N}} \ rightarrow \ sigma ^ * (\ ce {Si-H}) $ esquema de deslocalización
Por otro lado, las configuraciones de electrones naturales son las siguientes:
Atom | Configuración de electrones naturales ------ | ---------------------------------- N | [núcleo] 2s (1,53) 2p (5,12) Si | [núcleo] 3s (1.01) 3p (1.96) 3d (0.02) H | 1s (1,15)
Por lo tanto, la configuración electrónica de $ \ ce {N} $ , según el análisis de NBO, es $ \ ce {1s ^ {2} 2s ^ {1.53} 2p ^ {5.12}} $ . Además, el par único de nitrógeno es de $ \ pi $ carácter . Mirando más cerca del enlace $ \ ce {N-Si} $ vemos:
(Ocupación) Bond orbital / Coeficientes / Híbridos ----------------------------------------- -------------------------------------- 1. (1.97614) BD (1) N 1- Si 2 (81,00%) 0,9000 * N 1 s (33,32%) p 2,00 (66,66%) d 0,00 (0,02%) (19,00%) 0,4359 * Si 2 s (23,84%) p 3,16 (75,42%) d 0,03 (0,74 %)
Por lo tanto,
- El enlace $ \ ce {N-Si} $ está polarizado hacia $ \ ce {N} $ ( $ 0.9000 h_ \ ce {N} + 0.4359 h_ \ ce {Si} $ ), como se esperaba debido a la electronegatividad;
- El $ \ ce {Si} $ híbrido ( $ h_ \ ce {Si} $ ) es de carácter $ \ ce {sp ^ {3.16}} $ , como se esperaba; y
- El $ \ ce {N} $ híbrido ( $ h_ \ ce { N} $ ) es de $ \ ce {sp ^ {2.00}} $ carácter .
De acuerdo con la respuesta de Jan.